Обоснование строения бензола с точки зрения мезомерии
По просьбе нашего читателя постараемся описанную тему от 16:13 | 07.11.2018 раскрыть ещё глубже, сегодня рассмотрим Обоснование строения бензола с точки зрения мезомерии. Не будем разливать воду, а преступим рассмотрению этого вопроса.
Основное положение
Обоснование строения бензола с точки зрения мезомерии было сделано К. Ингольдом (1926 г.) После создания теории ковалентной связи. В реальной молекуле бензола электроны $\pi$-связей смещены к простым $\sigma$-связям, вследствие чего они в изолированном состоянии не существуют, а выравниваются между одинарными. Позже Л. Полинг предложил на основании квантово-механических представлений считать отсутствующими в молекуле бензола изолированные $\pi$-связи, которые, по его мнению, существуют в виде сплошного $\pi$-облака.
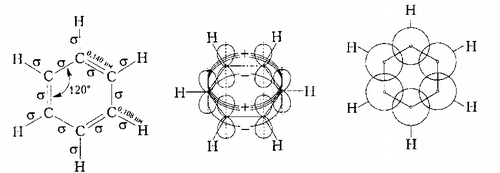
Физическими методами установлено, что молекула бензола имеет строение плоского шестиугольника, в котором все связи $C-C$ одинаковые с длиной 0,140 нм (рис. 1). Напомним, что для алканов составляет 0,154 нм, а для алкенов - 0,134 нм. Бензол является неполярной составом, и его дипольный момент равен нулю ($\mu$ = 0).
Рисунок 1. Строение бензола
Атом углерода находится в состоянии $sp2$-гибридизации, углы между звьяз¬камы $C-C-C$ равны сто двадцатого, а шесть остаточных электронов расположены перпендикулярно к плоскости кольца с параллельными осями и образуют сплошную электронное облако, или $\pi$-облако.
Итак, бензол представляет собой типичное соединение с шестицентровыми шестиелэлектронными делокализованными $\pi$-связями. Порядок связи в бензоле равен 1,667, что меньше, чем у этилена (2,0), но больше, чем в этане (1,0), и состоит, предположительно, из порядка простой $\sigma$-связи (1, 0) и доли (0,667) $\pi$-связи. Уменьшение доли $\pi$-связи является доказательством ее делокализации. Индекс свободной валентности атома углерода бензола равен 0,40, что значительно меньше, чем у этилена (0,732), и подтверждает меньшую способность бензола к реакциям присоединения.
Объяснить на современном уровне строение бензола можно с помощью метода валентных связей (ВС) или метода молекулярных орбиталей (МО).
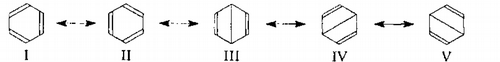
Так, метод ВС рассматривает бензол как результат суперпозиции (наложения) пяти основных резонансных структур - двух Кекуле (І-II) и трех, подобных структур Дьюара (III-V):
Рисунок 2.
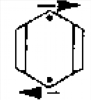
Квантово-механические расчеты показывают, что вклад структур с минимальной энергией I и II крупнее и составляет для каждой 39%, в то время как для структур III-V - всего по 7%. Такие структуры имеют большую энергию в результате очень слабой связи в 1,4-положении, фактически формально ''соединяет "между собой атомы углерода, поскольку расстояние между ними равно 0,280 нм. Правильнее было бы изобразить структуру Дьюара как
Рисунок 3.
Заключение
Конечно можно много говорить по теме Обоснование строения бензола с точки зрения мезомерии, но основную суть мы изложили по этому вопросу. Если вам нужно дополнительная консультация, пожалуйста пишите ваши сообщения нам на почту. Все поступившие вопросы рассматриваются и не остаются без ответа.
ПОМОГАЕМ УЧИТЬСЯ НА ОТЛИЧНО!
Выполняем ученические работы любой сложности на заказ. Гарантируем низкие цены и высокое качество.
Деятельность компании в цифрах:
Зачтено оказывает услуги помощи студентам с 1999 года. За все время деятельности мы выполнили более 400 тысяч работ. Написанные нами работы все были успешно защищены и сданы. К настоящему моменту наши офисы работают в 40 городах.
РАЗДЕЛЫ САЙТА
Ответы на вопросы - в этот раздел попадают вопросы, которые задают нам посетители нашего сайта. Рубрику ведут эксперты различных научных отраслей.
Полезные статьи - раздел наполняется студенческой информацией, которая может помочь в сдаче экзаменов и сессий, а так же при написании различных учебных работ.
Красивые высказывания - цитаты, афоризмы, статусы для социальных сетей. Мы собрали полный сборник высказываний всех народов мира и отсортировали его по соответствующим рубрикам. Вы можете свободно поделиться любой цитатой с нашего сайта в социальных сетях без предварительного уведомления администрации.
ЗАДАТЬ ВОПРОС
НОВЫЕ СТАТЬИ
- Убыточность по операциям страхования жизни
- Убыточность по операциям, отличным от страхования жизни
- Относительный показатель страховой убыточности
- Сущность страховой убыточности
- Формы социальной защиты
ПОХОЖИЕ СТАТЬИ