Особенности протекания процесса растворения в термодинамике
По просьбе нашего читателя постараемся описанную тему от 09:44 | 17.07.2016 раскрыть ещё глубже, сегодня рассмотрим Особенности протекания процесса растворения в термодинамике. Не будем разливать воду, а преступим рассмотрению этого вопроса.
Основное положение
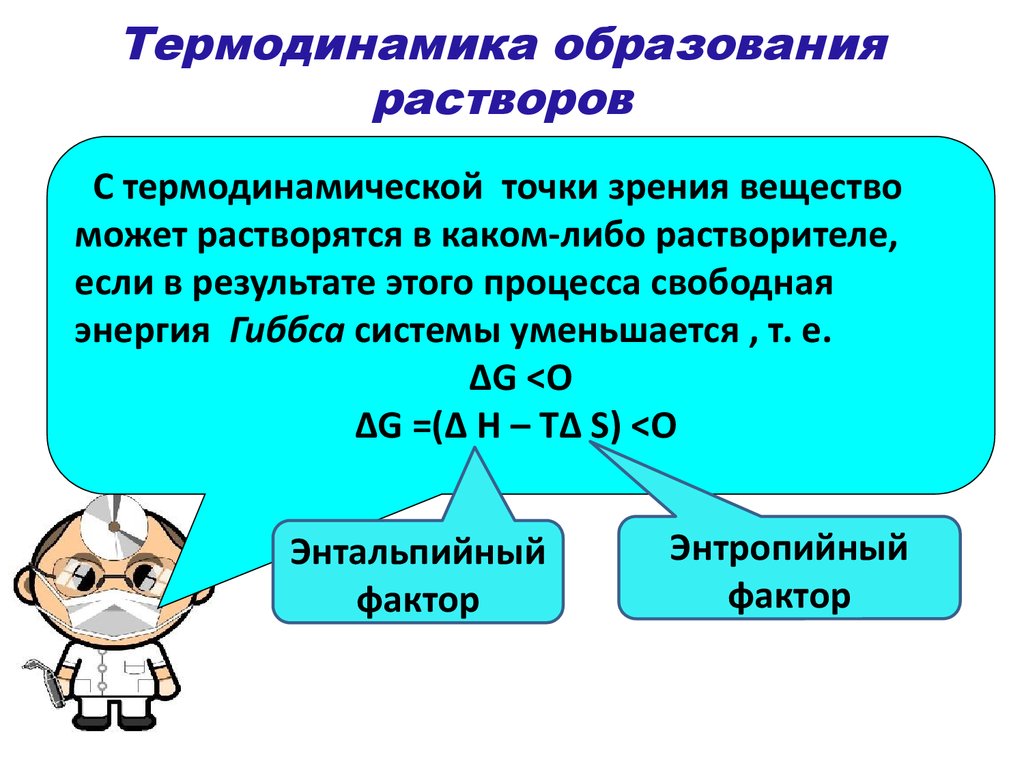
Рисунок 2. Термодинамика образования растворов.
Растворение в термодинамике протекает практически всегда самопроизвольно $(DG
Замечание 1
Равновесное положение может быть незначительно нарушено только после изменения начальной температуры, давления или введения других важных веществ.
Растворимость в термодинамике равна его итоговой концентрации в насыщенном растворе. Растворение небольших кристаллических веществ часто идет параллельно с поглощением внутренней теплоты ($DH > 0$ - затрата энергетического потенциала на разрыв химических взаимосвязей) и обычно сопровождается увеличением энтропии ($DS > 0$ – увеличение количества частиц). Согласно формуле Гиббса, $DG = DH – TDS$, тогда самопроизвольному протеканию процесса растворения кристаллических соединений в воде помогают крайне высокие температуры. Однако растворимость некоторых веществ, автоматически снижается с ростом температуры, так как $DS$ < $0$ при формировании гидратов уменьшается.
Пример 1
Это явление имеет особо серьезное значение для наиболее глубоких озер. Плотность теплой воды значительно меньше плотности холодной, поэтому теплая вода не перемешивается с холодной и остается на поверхности. Это затрудняет дальнейшее растворение кислорода в самых глубоких слоях воды и таким образом демонстрирует губительное воздействие на все формы жизни в воде.
Растворимость газов в жидкостях всегда увеличивается с повышением давления. (Это возможно обнаружить в производстве газированной воды). Растворимость жидкостей в жидкостях обычно повышается с изменением температуры и практически не зависит от первоначального давления.
Заключение
Конечно можно много говорить по теме Особенности протекания процесса растворения в термодинамике, но основную суть мы изложили по этому вопросу. Если вам нужно дополнительная консультация, пожалуйста пишите ваши сообщения нам на почту. Все поступившие вопросы рассматриваются и не остаются без ответа.
ПОМОГАЕМ УЧИТЬСЯ НА ОТЛИЧНО!
Выполняем ученические работы любой сложности на заказ. Гарантируем низкие цены и высокое качество.
Деятельность компании в цифрах:
Зачтено оказывает услуги помощи студентам с 1999 года. За все время деятельности мы выполнили более 400 тысяч работ. Написанные нами работы все были успешно защищены и сданы. К настоящему моменту наши офисы работают в 40 городах.
РАЗДЕЛЫ САЙТА
Ответы на вопросы - в этот раздел попадают вопросы, которые задают нам посетители нашего сайта. Рубрику ведут эксперты различных научных отраслей.
Полезные статьи - раздел наполняется студенческой информацией, которая может помочь в сдаче экзаменов и сессий, а так же при написании различных учебных работ.
Красивые высказывания - цитаты, афоризмы, статусы для социальных сетей. Мы собрали полный сборник высказываний всех народов мира и отсортировали его по соответствующим рубрикам. Вы можете свободно поделиться любой цитатой с нашего сайта в социальных сетях без предварительного уведомления администрации.
ЗАДАТЬ ВОПРОС
НОВЫЕ СТАТЬИ
- Убыточность по операциям страхования жизни
- Убыточность по операциям, отличным от страхования жизни
- Относительный показатель страховой убыточности
- Сущность страховой убыточности
- Формы социальной защиты
ПОХОЖИЕ СТАТЬИ