Химическая термодинамика и кинетика
По просьбе нашего читателя постараемся описанную тему от 09:44 | 17.07.2016 раскрыть ещё глубже, сегодня рассмотрим Химическая термодинамика и кинетика. Не будем разливать воду, а преступим рассмотрению этого вопроса.
Основное положение
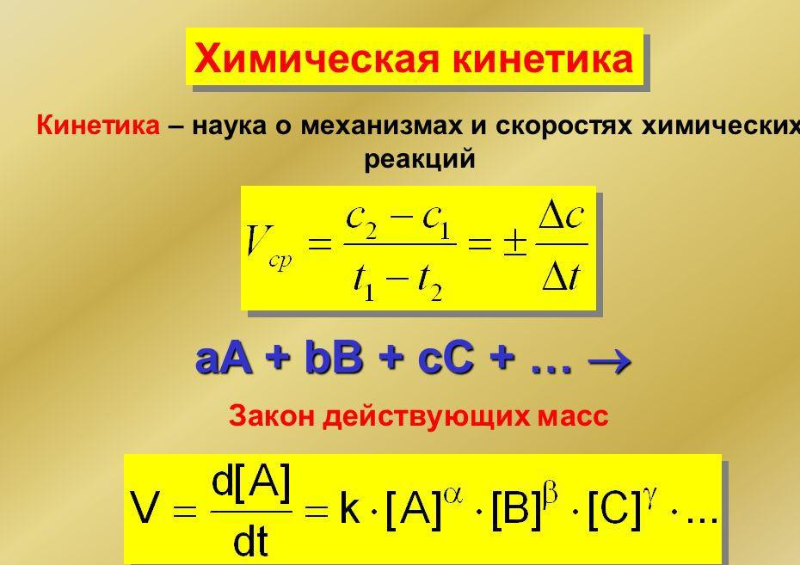
Рисунок 2. Химическая кинетика.
Определение 1
Взаимообмен внутренней энергией между активной системой и внешней средой тщательно и понятно описывают термодинамические законы. Использование принципов и постулатов термодинамики в химии позволяет исследователям решить важный вопрос о принципиальной вероятности различных химических процессов, конкретных условиях их появления, а также определить степень трансформации реагирующих веществ в процессах и оценить их дальнейшую энергетику.
Определение 2
Термодинамические законы рассматриваются по отношению к системе, которая поглощает энергию химических веществ. Получаемый концепцией энергетический потенциал обозначается знаком «+», отданный системой — знаком «—».
Переменные параметры который определяют состояние системы, называются величинами состояния. Среди них в науке наиболее часто применяются:
- температура рабочего тела;
- давление окружающей среды;
- объем и состав активной концепции.
Состояние системы и происходящие в ней изменения возможно охарактеризовать посредством основных функций состояния, напрямую зависящих от показателей химического элемента и от пути перехода изучаемого предмета из одного состояния в другое. К ним ученые относят внутреннюю энергию, энтропию энтальпию и изобарно-изотермический потенциал.
Замечание 2
Большинство экспериментов в химии проводится в открытых сосудах, то есть при постоянном, атмосферном давлении. Химическая кинетика исследует и описывает ключевые характеристики физического процесса, как скорость будущей реакции и прямая зависимость ее от внешних факторов.
Для удобства расчетов скорость химических процессов определяют по изменению концентрации действующих веществ за единицу времени. Для точного определения скорости реакции достаточно определить уровень концентрации в пространстве только одного из участвующих в системе элементов, причем абсолютно не важно какого - исходного или конечного.
В термохимических формулах все тепловые эффекты реакций записываются в расчете на 1 моль конечного или начального вещества. Поэтому здесь возможно допущение дробных коэффициентов. При химических процессах возникает диалектический закон борьбы противоположностей и единства системы. С одной стороны, любая концепция стремится к упорядочению – уменьшению переменной Н, а с другой стороны – к хаосу и беспорядку. Первая тенденция автоматически увеличивается с понижением температуры, а вторая – с ее постепенным повышением. Тенденцию к беспорядочному движению характеризует химическая величина, названная энтропией $S$ [Дж/(моль. К)].
Заключение
Конечно можно много говорить по теме Химическая термодинамика и кинетика, но основную суть мы изложили по этому вопросу. Если вам нужно дополнительная консультация, пожалуйста пишите ваши сообщения нам на почту. Все поступившие вопросы рассматриваются и не остаются без ответа.
ПОМОГАЕМ УЧИТЬСЯ НА ОТЛИЧНО!
Выполняем ученические работы любой сложности на заказ. Гарантируем низкие цены и высокое качество.
Деятельность компании в цифрах:
Зачтено оказывает услуги помощи студентам с 1999 года. За все время деятельности мы выполнили более 400 тысяч работ. Написанные нами работы все были успешно защищены и сданы. К настоящему моменту наши офисы работают в 40 городах.
РАЗДЕЛЫ САЙТА
Ответы на вопросы - в этот раздел попадают вопросы, которые задают нам посетители нашего сайта. Рубрику ведут эксперты различных научных отраслей.
Полезные статьи - раздел наполняется студенческой информацией, которая может помочь в сдаче экзаменов и сессий, а так же при написании различных учебных работ.
Красивые высказывания - цитаты, афоризмы, статусы для социальных сетей. Мы собрали полный сборник высказываний всех народов мира и отсортировали его по соответствующим рубрикам. Вы можете свободно поделиться любой цитатой с нашего сайта в социальных сетях без предварительного уведомления администрации.
ЗАДАТЬ ВОПРОС
НОВЫЕ СТАТЬИ
- Убыточность по операциям страхования жизни
- Убыточность по операциям, отличным от страхования жизни
- Относительный показатель страховой убыточности
- Сущность страховой убыточности
- Формы социальной защиты
ПОХОЖИЕ СТАТЬИ